【编者按】在上海市科学技术委员会资助(项目编号:22DZ2304300)下,澎湃新闻联合《世界科学》对获得国家及上海市科技奖励的成果进行科普化报道。
本文围绕2022年上海市自然科学奖一等奖项目“环形RNA生成和功能机制的研究”展开,该奖项由中国科学院分子细胞科学卓越创新中心陈玲玲研究员领衔获得。
她在非编码RNA领域深耕十余年,见证并推动了这个领域的发展。她领衔的团队发现了不带有多聚腺苷酸(polyA)尾巴或者N7-甲基鸟苷(m7G帽子)的非经典lncRNA新种类,包括sno-lncRNA、SPA RNA、circRNA等,并在阐明这些RNA的生物合成机制与功能、探索其生物医学应用方面成绩斐然。

陈玲玲说:“我现在45岁,我希望我的研究还能再有突破。”
在过去30年左右的时间里,非编码RNA一直是非常活跃的研究领域。从获得诺奖的小RNA干扰技术,到近年来备受关注的lncRNA,形形色色的非编码RNA在各种各样的生物学过程中发挥重要功能,并展现出多种多样的生物医学应用前景。
然而,究竟如何才能做好RNA研究?中国科学院分子细胞科学卓越创新中心研究员、分子生物学国家重点实验室副主任、核糖核酸功能与应用重点实验室主任陈玲玲与您一起走进RNA的世界。
RNA大家族:不只编码蛋白质
非编码RNA有哪些种类?这个领域的研究历程大概是怎样的?
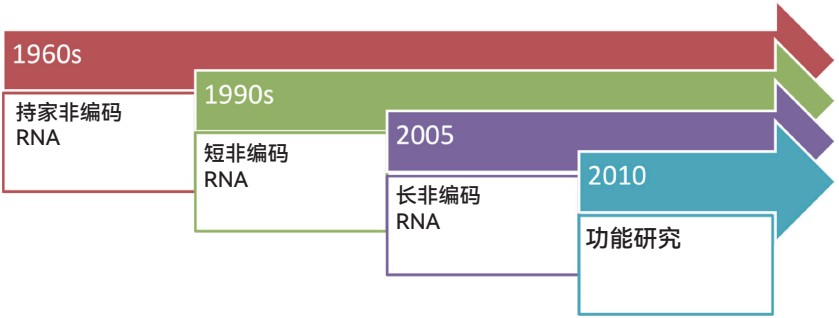
非编码RNA研究可以分为几个阶段。第一阶段是从20世纪60年代到80年代。这一时期,人们陆续发现了不同类型的持家非编码RNA,例如我们熟悉的核糖体RNA、转运RNA、小核RNA、小核仁RNA等。这些持家非编码RNA在细胞中的含量比较高,而且承担着非常重要的生理功能。
第二个阶段是从20世纪90年代初到2005年,这一时期人们陆续发现了一系列小非编码RNA,包括能够沉默基因表达的miRNA、与哺乳动物生殖有关的piRNA等。进一步的功能研究显示,这些小非编码RNA可以应用于基因表达调控、育种、基因治疗等许多领域。
事实上直到现在,人们对小RNA的研究也仍然没有停止。2006年,安德鲁 · 法尔(Andrew Fire)和克雷格 · 梅洛(Craig Mello)两位科学家因在小RNA干扰领域的研究获得了诺贝尔生理学或医学奖。2018年,美国食品药品管理局(FDA)批准了第一款小RNA药物,用于治疗由转甲状腺素蛋白淀粉样变性引发的神经损伤。
非编码RNA研究的第三个阶段大概是从2005年到2015年,是lncRNA等更多种非编码RNA大规模发现的阶段。这是因为在2005年左右,人们开始使用覆瓦式阵列(Tiling Array)等基因组学、转录组学的方法对基因组进行大规模测序,发现以前认为不转录的基因区域实际可以被转录,产生了众多与编码蛋白质的信使RNA类似——带有5′端m7G帽子和3′端polyA尾巴——但不编码功能蛋白质的长非编码RNA。目前人们已经发现了数十万条不同的lncRNA。后来,包括我们团队在内,人们又发现具有特殊结构的长非编码RNA分子家族,它们不带m7G帽或者polyA尾巴,例如我们研究比较多的、两端以小核仁RNA结尾的sno-lncRNA和circRNA等。
非编码RNA的发现与研究历程
从2010年到现在,人们开始更多地关注和研究lncRNA的生物学功能。对于形形色色的非编码RNA,人们尝试去研究它们在不同的细胞环境下与哪些蛋白质相互作用,折叠成怎样的构象,又是以何种机制去发挥怎样的生理学功能。对于这些问题,目前还不能用一个通用的法则来比较简单地阐述相关机制和规律,因此我认为对于RNA研究者来说,目前是一个充满挑战、非常重要的阶段。
将来还会发现新类型的非编码RNA吗?
我觉得可能会。按照非编码RNA的长短,我们可以非常宽泛地把它分为长非编码RNA和短非编码RNA,而在这样的大类之下,不同的RNA有不同的来源,它们来自不同的细胞,有不同的生物合成方式,折叠成不同的构象,运用不同的作用机制,发挥着不同的生理病理功能。我认为在目前研究比较少的体系中,比如极端生物、动植物生理病理以及人体内部的一些细胞亚型中,很可能还会发现由不同的生物合成途径产生的新类型的非编码RNA。
您是如何进入这一研究领域的?在领域中做了哪些比较好的工作?
我的研究经历中有一些机缘巧合,但又是一脉相承、有迹可循的。
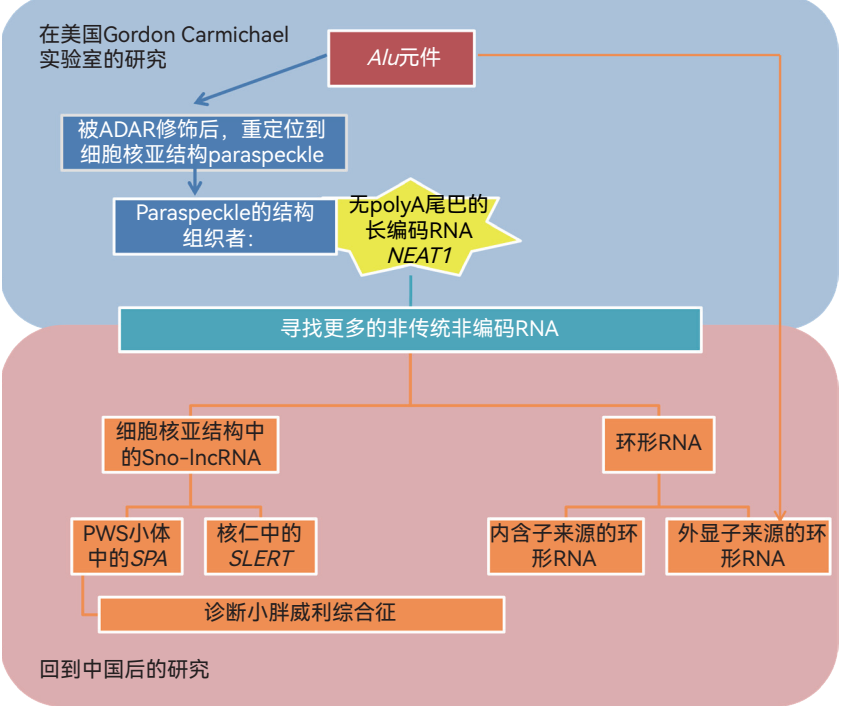
我2004年到美国读研究生的时候,导师戈登 · 卡迈克尔(Gordon Carmichael)教授是做病毒学研究的,而我的研究对象是实验室刚开始关注的基因元件Alu。Alu是灵长类动物基因组中特有的一类细胞核短重复序列(SINEs),它们在基因组中的占比可以达到10%~11%。我当时发现,mRNA 3′端区域含有反向重复的Alu元件,可以导致这样的mRNA亚细胞定位发生改变,它们不再出核,而是停留在细胞核中一个名为paraspeckle的亚结构中,随后我和其他的团队研究发现,paraspeckle的结构组织者之一正是lncRNA,叫做m7G。这就是我与非编码RNA最初的接触。而巧合的是,在当时已经发现的一万多种lncRNA中,只有两种没有polyA尾巴,而m7G就是其中之一。于是我就想问:转录组中是不是还有其他没有polyA尾巴的新类型的非编码RNA?
当时,我博士刚毕业就获得了20万美元的研究经费,利用这笔经费,我在博士毕业后仍然留在卡迈克尔实验室,半独立地开展研究工作。2011年,我们在《基因组生物学》(Genome Biology)杂志发表文章,报道了建立无polyA转录组分离纯化的方法和我们在基因组范围内搜索non-polyA RNA的结果,发现了大量源于内含子和外显子的无polyA的RNA信号。
在这个时期,2010年底,我也在中国科学院分子细胞科学卓越创新中心(原中国科学院生物化学与细胞生物学研究所)建立了我的研究团队。“什么机制导致这些无polyA外显子和内含子序列稳定存在”是我建立实验室之初想要回答的科学问题。
2012年,我们在《分子细胞》(Molecular Cell)上报道了两端以小核仁RNA结尾的sno-lncRNA新家族。从sno-lncRNA出发,我们开始关注与之相关的细胞核亚结构,其中有两个比较重要的工作:一个是发现多个sno-lncRNA及类似的SPA lncRNAs在小胖威利综合征(PWS)患者体内缺失,除了解析它们可能的分子机制,我们最近也证实了它们的缺失可以作为检测这种疾病的标志物;第二是我们对定位在核仁的一个sno-lncRNA——SLERT进行了一系列研究,解析了它在核糖体RNA转录调控和核仁结构维持中的重要作用,发现了新的致密纤维组分外侧区域(PDFC),拓展了对于核仁的认识。
在2013、2014年发表的两篇文章中,与计算生物学家合作,我们先后报道了内含子来源和外显子来源的环形RNA。其中外显子来源的环形RNA之所以能够成环,是因为在外显子两侧的内含子上有互补的顺式作用元件Alu重复序列,Alu元件形成瞬时配对将外显子的两端拉近从而帮助其环化。这显然又是一个巧合,正是因为我自己以前研究3′ UTR Alu元件,我们才能在几年之后重新遇到它的时候,较快速地阐明这类环形RNA的产生机制。
从2013、2014年到现在的十年中,我们持续在研究环形RNA,通过系统阐明环形RNA加工、折叠和降解特性,将环形RNA的生成与作用机制相耦联开展研究,从而揭示了其全新功能,并探索其与自身免疫疾病的关联。
以上就是我在这个领域的主要研究经历。从分子发现开始,到后面进行功能机制研究,再到发现它的临床应用潜力,这是一个非常充实、非常有趣的科研经历。
陈玲玲的RNA研究经历
lncRNA研究:尚无规律认知,需要小心谨慎
非编码RNA在生命系统中扮演着怎样的角色?它们和蛋白质谁更重要?
首先持家非编码RNA肯定是非常重要的,它们是维持生命活动所必需的。而其他类型的非编码RNA,大部分更偏重于调控性的功能。如果非要比较它和蛋白质谁更重要,蛋白质的功能会更关键一些,但是非编码RNA的参与及功能调控不可缺少。
值得强调的是,非编码RNA在发挥功能的过程中常常是和蛋白质密不可分的,它们的合成既依赖蛋白质,也需要和蛋白质相互作用形成复合物,才能折叠成具有功能的构象,进而发挥生物学功能。另一方面,许多蛋白质同样要依赖非编码RNA作为其“分子伴侣”“脚手架”“适配体”等发挥功能。
RNA的折叠比蛋白质简单吗?
不,我认为和蛋白质相比,RNA的结构更加复杂多样和多变。
蛋白质的折叠大致遵循安芬森法则(Anfinsen's rule),也就是蛋白质折叠的热力学猜想:一级序列决定三维结构,三维结构决定功能。而单链的RNA,尤其是长的单链RNA,它的柔性非常强,单独存在就很容易打结(形成knots),较难形成功能性的折叠构象。所以在细胞中,它就需要和不同的蛋白质以及其他生物分子相互作用,在它们的帮助下完成折叠。而且在RNA合成和发挥功能的不同阶段,它还会和不同的分子相互作用、形成不同的构象。也就是说,RNA的折叠不只取决于它的序列本身,而是需要更多维地考虑细胞中的其他分子。这就意味着在当前的知识框架下,还没有一个简单的理论能够概括RNA的折叠机制,因而很难对RNA的结构进行准确预测。
对于lncRNA,我们已经有比较深入和完整的认识了吗?
lncRNA的种类非常多,参与各种生命活动。同时这个领域的研究也很难,可以说,直到目前为止,我们对lncRNA还缺乏规律性的认知。举例来讲,在20世纪90年代初,人们发现了一个非常重要的lncRNA,叫作Xist,它在哺乳动物雌性性染色体的随机失活过程中发挥着非常关键的作用,因此也吸引了许多研究者的关注。甚至可以说,在2005年Tiling Array出现以前,是这一个RNA撑起了整个lncRNA研究领域。然而直到现在,三十多年过去了,围绕Xist发挥功能的机制,学界仍然有许多争论。
LncRNA非常多样,有些只需要数百个碱基就可以发挥功能,而另一些则可以长达3.6万个碱基——Xist就很长,有2.1万碱基。如此长的lncRNA要发挥功能,可能是依赖于其中一些功能性的单元模块从而与一些功能因子互作,但是这些关键单元如何形成、如何折叠、如何与蛋白质相互作用,目前还没有发现一个普适性的规律。
具体到环形RNA,它和线性的lncRNA相比又有哪些特点?
RNA成环以后,它的结构就会变得更稳定,因此在细胞中它的降解和合成速率通常都很慢。但是在一些生理或病理条件下,它又可以被快速降解,它们的缓慢生成和快速降解使环形RNA能够作为一个群体发挥调控功能。此外,小于500个核苷酸的短链环形RNA也很容易形成分子内的双链结构,从而折叠为一类特殊结构的分子与蛋白质相互作用,如抑制免疫因子——双链RNA活化的蛋白激酶(PKR),进而参与天然免疫的调控。这些研究提示环形RNA很适合被开发为RNA适配体,有望在生物医药领域应用。
LncRNA和circRNA的研究方法已经成熟了吗?
人们一直在不断拓展RNA的研究方法。目前,蛋白质研究中可以做的免疫沉淀、生物成像、结构解析等手段,在RNA中也可以做,但是相对来讲,还不如蛋白质研究那么便捷,并且精度也尚不能达到蛋白质研究的程度。此外,研究环形RNA还会更难一点,因为研究者需要在细胞中把环形RNA和与它序列相同的线性RNA区分开来,而且在各种实验中,也都需要做好对照——加入同序列线性RNA的对照组。
我认为做RNA研究,一方面要针对你所研究的RNA特性,找到最适合它的研究方法,另一方面也需要跳出现有的研究框架,去探索新的研究方法。
“跳出现有框架的新方法”可能会向哪些方向发展?
首先,因为RNA的结构柔性很高,也时常处于动态之中,所以需要更高的分辨率,更加实时动态地去捕捉它的状态。如何实现?RNA功能研究需要整合跨学科方法,包括RNA化学、RNA生物物理学、基于RNA的细胞生物学等手段,最终目标是在单分子和原子分辨率上解析非编码RNA及其与蛋白质形成的复合物的结构,阐明内在的RNA结构-功能联系。
其次,我们将更加关注RNA在生物体内的真实状态及其与功能分子的互作机制。目前很多研究都是在体外培养的细胞系中进行的,而这可能与生物体内的细胞状态大相径庭。
此外,我们还将更加细致地研究RNA的生理功能。RNA在物种间的保守性并不高,一种RNA可能只在特定的物种体内、在特定的生理病理条件下才能发挥某种特定的功能,这就需要我们在研究中非常小心。因此,未来研究有必要开发合适的动物模型和人类类器官研究体系,用于非编码RNA相关的表型分析、疾病模型和体内治疗潜力等研究。
对于想要投身非编码RNA研究的其他领域研究者,您有什么建议?
非编码RNA与生命活动息息相关,与肿瘤、神经、免疫等很多领域相联系,因此这些领域的研究者也都开始涉足RNA研究或利用RNA研究手段促进相关领域发展。我认为最重要的是,研究者需要知道RNA不是蛋白质,需要认真解析所关注的那个特定的lncRNA特性,例如首先搞清楚它在基因组上的位置、它的生成途径、它的亚细胞定位等基本信息,然后才能选择适合它的研究方法,从而得到可信的研究结果。比如说,如果关注的lncRNA定位在细胞核中,而研究者像敲低蛋白质一样简单地用RNAi技术去敲低它,那么这些小RNA可能根本就不能进入细胞核,得出的实验结论也就很可能是具有误导性的。
临床应用,曙光已现
有一些lncRNA和circRNA已经展现出临床应用前景,能介绍一下这方面的情况吗?
lncRNA和circRNA会参与一些疾病的发生,因此有可能用于这些疾病的诊断和潜在治疗。
作为诊断的生物标志物,一个例子就是我刚刚提到的,利用一种sno-lncRNA的缺失,通过优化的PCR等手段,使我们能够在微升血样的水平或者使用干血斑的样品很容易地检测出它们在小胖威利综合征中的缺失,可以作为一种便捷的手段辅助PWS检测。如果后期能够推向临床,甚至可以在新生儿中做常规筛查,将有利于患儿和患儿家庭,因为如果能够早诊断、早干预,通过补充生长激素,患儿是有机会像正常孩子一样生活的。
在疾病治疗方面,有些疾病是由具有调节功能的lncRNA发生异常导致的,所以补充这种RNA就可以产生治疗效果。这种方式甚至不需要补充完整的长非编码RNA,而是将lncRNA中发挥功能的元件 ——可能只有20个核苷酸 —— 做成RNA适配体药物,进行潜在治疗。而且,因为circRNA更加稳定,它要比lncRNA更适合做成适配体。我们研究组近期也在做相关工作,发现circRNA适配体具有治疗PKR过度激活有关的炎症性疾病的潜力。此外,体外合成的有正确折叠构象的环形RNA一般具有低免疫原性,也为下一代RNA药物研发提供新的机遇。
这些年我自己的想法也在不断变化。如果是在五年前,我们研究组做出一个原创发现,可能会侧重考虑发表文章,然后就去研究下一个问题;而现在有了一个发现之后,我会进一步思考,想一想这个发现可能有怎样的应用,能为人们的健康带来怎样的帮助。为此,我会去寻找合适的合作者,希望他们能够帮我们把这些想法转化为实际应用。
除了专注于基础研究的探索,一些科学家也可以思考原创发现面向应用转化的可能,这样也许可以为研究经费的价值体现提供一个新的出口。
在生物医学成果转化方面,您认为中国目前还需要怎样提高?
我觉得在从科技创新到技术应用的这条路上,我们还缺少各种类型的人才。因为在这个链条上,需要的不只是科学家,还需要政策上的扶持、社会力量的投入,需要经验丰富的、具有生命科学素养的政策对接人和企业运营者。
在过去十年中,中国对非编码RNA这个领域有比较大的投入,也培养了一批人才,我希望这批人不仅能成为RNA研究的中坚力量,也可以成为原创性RNA应用转化的中坚力量,大家一起努力把这个领域越做越好。
女性做科研:逢山开路、遇水搭桥,绝不放弃
科学家应该承担哪些社会责任?您自己会做些什么?
中国科学院认为科学家应该心系国家事、肩扛国家责。我觉得这句话说得特别好。我很开心能生活在一个尊重知识、尊重人才、尊重劳动、尊重创新的时代,让我能够去做自己想做的科研工作,也获得精神上的回馈。
具体到我个人,首先就是要做好科研工作,我现在45岁,我希望自己不要在这里就停滞不前了,而是还能再有新发现、新突破。其次我希望能带好团队,为国家培养相关的人才。作为一个重点实验室的主任,我会努力扶持青年人才,充分利用自己在RNA领域的研究经验,多和他们交流,至少在他们回国初期最需要支持的一段时间里,能为他们提供支持和帮助。此外,我和我的团队还会积极参与科普工作,提高全民尤其是青少年儿童对科研的兴趣和热情,把科研的种子播在他们幼小的心灵上,让他们以成为科学家、从事科学相关的工作为荣。
对于年轻的科研人员,尤其是女性科研人员,您有什么建议?
做科研是一件很美好的事情。因为这是一项追求真理的工作,所以做科研也是一件很酷的事情,同时让我们有机会去体验很不一样的人生。研究的英文叫作research,拆解一下就是re-search,这意味着它是一个曲折的但是会螺旋式上升的过程。所以我希望研究者在任何时候都要坚持,不要放弃,最终一定会有收获。
对于女性科研人员,我有太多话想说。作为一名女性导师,我想对女生们说:不要让你拿到博士学位的那一天成为你职业生涯的终点。在生命科学领域,研究生中女性比男性更多,但是她们中能够坚持科研道路,最终成为教授、研究员的比例非常低。这种差异表明,许多女性科研工作者在职业生涯早期就离开了活跃的学术研究一线。
因此我想呼吁青年的女性科学家,不论多难,只要你喜欢做科研,就一定要坚持。作为女性,我十分理解我们还要承担来自作为母亲、作为子女的社会责任和压力,但在遇到困难的时候,少些抱怨、不怕苦累,积极寻求家人、单位和社会的帮助,着力去解决问题,借助大家的力量帮自己度过最艰难的阶段。哪怕是在生完孩子的最初两年,确实因没人帮忙而不得不离开,等这两年克服过去,还可以重回岗位。一定不要轻易说“我不干了”,要坚定信念、坚持自我并激励自我,不要轻易掐灭心中的科研火焰。
此外,作为在职业中期的一名女性科研人员,我同样面临着困难和压力——要协调好自己作为团队负责人、作为母亲、作为子女、作为妻子的角色常常并不容易。但是同样的,我们也可以多找渠道来纾解自己的压力,采取更高效的方式,坚持自己对科研的初心。
术语对照
lncRNA.......................................................... long non-coding RNA
长非编码RNA
snoRNA............................................................ small nucleolar RNA
小核仁RNA
sno-lncRNA.................................. 含有小核仁RNA的长非编码RNA
SPA RNA................ 5′snoRNA capped and 3′polyadenylated RNA
5′端有小核仁RNA帽子、3′端有多聚腺苷酸尾巴的RNA
circRNA......................................................................... circular RNA
环形RNA
rRNA.......................................................................... ribosomal RNA
核糖体RNA
tRNA.............................................................................. transfer RNA
转运RNA
snRNA................................................................. small nuclear RNA
小核RNA
miRNA............................................................................... microRNA
微小RNA
piRNA............................................................. Piwi-interacting RNA
Piwi相互作用RNA
mRNA...................................................................... messenger RNA
信使RNA
ADAR................................ Adenosine Deaminases Acting on RNA
RNA腺苷脱氨酶

陈玲玲(右)和学生在实验室
【编者按】在上海市科学技术委员会资助(项目编号:22DZ2304300)下,澎湃新闻联合《世界科学》对获得国家及上海市科技奖励的成果进行科普化报道。
本篇报道围绕2022年上海市自然科学奖一等奖项目“环形RNA生成和功能机制的研究”展开,该奖项由中国科学院分子细胞科学卓越创新中心陈玲玲研究员领衔获得。
神秘的SC35核斑
1989年的秋天,哈佛医学院汤姆·马尼亚蒂斯(Tom Maniatis)实验室的博后付向东在筛选了几百株单克隆细胞系后,终于鉴定出了一个全新的剪切因子——SC35。1
付向东发现,SC35在细胞核中的分布呈现出有规律的斑点状。经过与冷泉港实验室的大卫·斯佩克特(David Spector)的合作,他们发现SC35组成的斑点与大卫早先发现的“核斑”结构高度重合。他们推测,SC35核斑为RNA分子的剪切提供了特殊的活动场所。
但SC35核斑的复杂程度远不止于此。
将近20年以后,借着基因组学技术发展的东风,哈佛医学院的安德鲁·切斯(Andrew Chess)团队发现了两条名为NEAT1和NEAT2的长链非编码RNA。顾名思义,非编码RNA本身并不能编码产生蛋白质,但能以其他方式调节细胞活动。安德鲁团队发现,NEAT2(人类肺腺癌转移相关转录本1,简称MALAT1)集中在SC35核斑内部,而NEAT1分布在SC35核斑外围的一处名为“旁斑”(paraspeckle)的结构之中。
2009年,包括康涅狄格大学戈登·卡迈克尔(Gordon Carmichael)在内的四个不同的研究团队相继独立地发现NEAT1对于维持旁斑结构的稳定至关重要。4-7陈玲玲彼时正是戈登指导的博士研究生,她在博士阶段研究发现NEAT1是旁斑的形成所必需的RNA,在人胚胎干细胞发育分化的过程中,NEAT1能通过影响旁斑的形成,进而对信使RNA转移出细胞核的效率进行调控。
陈玲玲关注到了一个有趣的现象:在当时已经鉴定出的上万种长链非编码RNA之中,NEAT1和NEAT2是唯二在末端不存在多聚腺嘌呤“poly(A)尾巴”的例外。
这令她不禁好奇:在茫茫的基因组中,“poly(A)尾巴”缺失的NEAT1和NEAT2是否还有其他“亲戚”呢?
从sno-lncRNA的发现到“滴血验病”的临床可能
2009年博士毕业以后,陈玲玲作为独立研究员获得康涅狄格州干细胞研究经费的种子基金,与当时在同一研究机构工作的杨力博士(现任复旦大学教授)合作,开始对“poly(A)尾巴”缺失的长链非编码RNA进行了系统性研究。2010年陈玲玲回国,在中国科学院原上海生物化学与细胞生物学研究所组建了自己的研究团队。
随着研究进展,陈玲玲和杨力推测,NEAT1和NEAT2这两个特例的背后很可能还隐藏着一类新型的RNA分子。经过两年的研究,他们一共找到了超过300种 “poly(A)尾巴” 缺失的长链非编码RNA。
有趣的是,其中表达量比较高的几个有代表性RNA分子,在基因组中的位置竟然也非常集中,都坐落于15号染色体q11到q13间一段跨度为100kb左右的区域之中。
这几个“poly(A)尾巴” 缺失的新类型RNA分子,由于在它们的头尾都具有snoRNA的特征序列,因此被陈玲玲命名为“sno-lncRNA”。
随后的研究中,陈玲玲团队又揭示了一类特别的分子家族,称为SPA(5’snoRNA capped, 3’polyadenylated RNA),它们特别之处在于:5’末端是snoRNA ,但3’末端则具有poly(A)尾巴。
他们进一步研究发现sno-lncRNA和SPA,为一种名为“小胖威利症”罕见遗传病的临床诊断提供了新的希望。
在人群中,平均每一万到三万人之中就会有一人不幸患有“小胖威利症”:病童往往身材异常肥胖,神经发育迟缓。
幸运的是,如果病童能及时得到生长激素的治疗,病症就能得到有效缓解。
但临床上的困难在于,很多病童在被诊断出病症的时候,已经错过了接受生长激素治疗的最佳时期。
那么,是否能通过基因水平的诊断在孩子刚刚出生的时候就对疾病风险进行预测呢?
事实上,人类遗传学研究发现,15号染色体q11到q13间一段跨度为100kb左右区域的片段缺失是导致绝大部分“小胖威利症”发病的病因。
很遗憾,这一段和“小胖威利症”相关的基因片段中并没有编码蛋白质的序列,因此不存在蛋白水平的疾病诊断靶点。同时,由于病人两条15号染色体中,只有一条染色体存在片段缺失,并通过“基因印记”的机制,片段缺失的那份拷贝会被表达出RNA,因此也难以通过DNA水平直接对发病风险进行预测。
如今,这些新RNA的发现则令人看到了另一种可能性:是否可以对15号染色体q11到q13间的sno-lncRNA水平进行测量,并将其发展为一种新型的“小胖威利症”诊断手段呢?
2023年,这一临床转化方向的努力初奏凯歌:陈玲玲团队与浙江省儿童医院邹朝春教授团队合作发现,在正常人体内的1微升血液样品中存在上千个sno-lncRNA分子,而这些sno-lncRNA分子在“小胖威利症”患者中的含量则可忽略不计!
总之,这些新分子家族的发现为人们认识“小胖威利症”病理和发展新型检测手段提供了源头依据。
被低估的环形RNA:一条新型免疫通路的发现
除了以上新类型长链非编码RNA,陈玲玲和杨力对于另一类特殊的长链非编码RNA很感兴趣:此前就有研究者发现,在一些信使RNA、长链非编码RNA成熟的过程中,其中的一小部分会头尾相连在一起,形成环形RNA分子。
相较于线性RNA分子,这些环形RNA分子表达水平低,但同时在体内也更加稳定。
这些环形RNA分子是随机产生的吗?陈杨团队合作相继报道了内含子来源的环形RNA和外显子反向剪接来源的环形RNA的普遍存在,提出了可变环化的现象(即一个基因可以产生多个环形RNA)及其发生机制。
那么这些普遍表达的环形RNA是否具有生物学功能呢?通过解析环形RNA分子家族“生老病死”的规律,他们揭示了环形RNA具有重要功能和应用潜能。
首先,陈玲玲实验室的博士研究生张杨设计了一个新生环形RNA捕获检测体系,发现了环形RNA产生效率低,但是稳定性好。
陈玲玲实验室的博士研究生李响设计了一个遗传学筛选实验:他通过一套诱导表达系统,让一段基因序列在刺激下高水平表达,如果表达出的序列是线性的,那么不会发出荧光信号;与之相反,如果表达出的序列形成了环形RNA,则会产生出来自环形RNA蛋白表达产物的强烈红色荧光信号。
在这套表达系统中,李响让细胞感染了siRNA病毒文库,尝试对各个基因逐一敲低。他猜想如果存在调节环形RNA生成的基因,那么通过siRNA破坏这些基因,会降低环形RNA的产生效率。因此他将兴趣集中在那些被敲除后会导致红色荧光信号降低的基因,将其作为后续研究的候选基因。
完整的一轮筛选过后,李响发现了103个候选基因,它们可以表达出能与RNA进行结合的蛋白产物。出乎他意料的是,其中竟然有16个与免疫系统响应病毒感染通路相关。
难道说,产生多少的环形RNA,会由免疫通路的激活程度来决定吗?
实验结果支持了这个令人兴奋的猜想,病毒的感染的确会导致免疫细胞中环形RNA的数量下降。
接下来,研究者将注意力集中在了一个名为ILF3的候选基因上。
ILF3基因可以编码表达出NF90和NF110两个不同的免疫分子。有趣的是,NF90和NF110可以在细胞核内结合,处于从线性向环形转化过渡阶段的RNA分子,通过稳定其构象促进环形RNA分子的产生。
当病毒感染入侵免疫系统时,大量的NF90和NF110免疫因子进入细胞质对病毒的遗传物质进行围剿。这样一来,细胞核内的NF90和NF110数量减少,环形RNA的产生效率也随之降低;
与此同时,陈玲玲团队还发现免疫系统激活的核酸内切酶RNase L,可以快速降解细胞质中的环形RNA。
两个因素合在一起,环形RNA产生效率降低,分解速度提高,总体的数目自然也随之快速降低下来。
那么问题来了,受到如此精细调控的环形RNA分子,在细胞中究竟发挥着怎样的生物学功能呢?
对于免疫分子NF90而言,它结合环形RNA的亲和度要比同样序列的线性RNA更加强。
那么在其他免疫分子之中,是否也有类似于NF90具有更偏好结合环形RNA的情况存在呢?
利用生物化学手段,陈玲玲团队的博士研究生刘楚霄系统地筛选了免疫通路中RNA结合蛋白对环形RNA的结合能力——研究者最终发现免疫分子PKR能紧密结合环形RNA,并且活性也会随着结合环形RNA而被抑制。
为什么环形RNA会抑制PKR呢?刘楚霄设计了化学方法标记细胞内的环形RNA分子的单链和双链的区域,并结合高通量测序等手段,预测环形RNA在细胞内的折叠状态。这使得他们发现很多不同的环形RNA分子具有类似的折叠方式,即形成分子内的短双链结构 (这完全不同于具有一样序列的线性RNA)。这一环形RNA独具的特征使其特异结合并抑制免疫分子如PKR等在正常情况下的过度激活(如图示)。

图注:环形RNA分子能够结合并抑制免疫分子PKR的活性,为治疗红斑狼疮提供了新思路。19
关键的是,免疫分子PKR活性的过度激活,正是一部分红斑狼疮患者的重要特征。
陈玲玲团队联合上海交通大学医学院附属仁济医院的沈南教授团队发现,在红斑狼疮患者的免疫细胞中的环形RNA水平要低于对照人群。
那么是否有可能将环形RNA设计成具有特殊折叠构象的RNA药物,通过抑制免疫分子PKR来缓解红斑狼疮患者的症状呢?
陈玲玲团队设计出了低免疫活性的环形RNA分子,并初步在细胞实验中进一步验证了它们对于PKR免疫通路的抑制作用。
环形RNA分子,未来是否能在PKR异常激活的炎症性疾病模型乃至人体临床试验中取得成效呢?最近陈玲玲团队的研究表明,体外合成的环形RNA不仅是PKR的高效抑制剂,更重要的是体外合成的环形RNA无需像mRNA一样进行额外修饰去除免疫原性,环形RNA本身就具有很低的免疫原性,因此具有良好的应用前景。
我们乐观地等待它们接受事实的检验。
术语对照:
snoRNA——小核仁RNA
sno-lncRNA——含有小核仁RNA的长非编码RNA
siRNA——小干扰RNA
PKR——双链RNA活化的蛋白激酶
参考文献:
1.Fu, X. D. & Maniatis, T. Factor required for mammalian spliceosome assembly is localized to discrete regions in the nucleus. Nature 343, 437-441, doi:10.1038/343437a0 (1990).
2.Spector, D. L., Fu, X. D. & Maniatis, T. Associations between distinct pre-mRNA splicing components and the cell nucleus. Embo j 10, 3467-3481, doi:10.1002/j.1460-2075.1991.tb04911.x (1991).
3.Hutchinson, J. N. et al. A screen for nuclear transcripts identifies two linked noncoding RNAs associated with SC35 splicing domains. BMC Genomics 8, 39, doi:10.1186/1471-2164-8-39 (2007).
4.Chen, L. L. & Carmichael, G. G. Altered nuclear retention of mRNAs containing inverted repeats in human embryonic stem cells: functional role of a nuclear noncoding RNA. Mol Cell 35, 467-478, doi:10.1016/j.molcel.2009.06.027 (2009).
5.Clemson, C. M. et al. An architectural role for a nuclear noncoding RNA: NEAT1 RNA is essential for the structure of paraspeckles. Mol Cell 33, 717-726, doi:10.1016/j.molcel.2009.01.026 (2009).
6.Sasaki, Y. T., Ideue, T., Sano, M., Mituyama, T. & Hirose, T. MENepsilon/beta noncoding RNAs are essential for structural integrity of nuclear paraspeckles. Proc Natl Acad Sci U S A 106, 2525-2530, doi:10.1073/pnas.0807899106 (2009).
7.Sunwoo, H. et al. MEN epsilon/beta nuclear-retained non-coding RNAs are up-regulated upon muscle differentiation and are essential components of paraspeckles. Genome Res 19, 347-359, doi:10.1101/gr.087775.108 (2009).
8.Yang, L., Duff, M. O., Graveley, B. R., Carmichael, G. G. & Chen, L. L. Genomewide characterization of non-polyadenylated RNAs. Genome Biol 12, R16, doi:10.1186/gb-2011-12-2-r16 (2011).
9.Yin, Q. F. et al. Long noncoding RNAs with snoRNA ends. Mol Cell 48, 219-230, doi:10.1016/j.molcel.2012.07.033 (2012).
10.Wu, H. et al. Unusual Processing Generates SPA LncRNAs that Sequester Multiple RNA Binding Proteins. Mol Cell 64, 534-548, doi:10.1016/j.molcel.2016.10.007 (2016).
11.Sahoo, T. et al. Prader-Willi phenotype caused by paternal deficiency for the HBII-85 C/D box small nucleolar RNA cluster. Nat Genet 40, 719-721, doi:10.1038/ng.158 (2008).
12.de Smith, A. J. et al. A deletion of the HBII-85 class of small nucleolar RNAs (snoRNAs) is associated with hyperphagia, obesity and hypogonadism. Hum Mol Genet 18, 3257-3265, doi:10.1093/hmg/ddp263 (2009).
13.Sun, J. R. et al. Using sno-lncRNAs as potential markers for Prader-Willi syndrome diagnosis. RNA Biol 20, 419-430, doi:10.1080/15476286.2023.2230406 (2023).
14.Zhang, Y. et al. Circular intronic long noncoding RNAs. Mol Cell 51, 792-806, doi:10.1016/j.molcel.2013.08.017 (2013).
15.Zhang, X. O. et al. Complementary sequence-mediated exon circularization. Cell 159, 134-147, doi:10.1016/j.cell.2014.09.001 (2014).
16.Zhang, X. O. et al. Diverse alternative back-splicing and alternative splicing landscape of circular RNAs. Genome Res 26, 1277-1287, doi:10.1101/gr.202895.115 (2016).
17.Zhang, Y. et al. The Biogenesis of Nascent Circular RNAs. Cell Rep 15, 611-624, doi:10.1016/j.celrep.2016.03.058 (2016).
18.Li, X. et al. Coordinated circRNA Biogenesis and Function with NF90/NF110 in Viral Infection. Mol Cell 67, 214-227.e217, doi:10.1016/j.molcel.2017.05.023 (2017).
19.Liu, C. X. et al. Structure and Degradation of Circular RNAs Regulate PKR Activation in Innate Immunity. Cell 177, 865-880.e821, doi:10.1016/j.cell.2019.03.046 (2019).
20.Liu, C. X. et al. RNA circles with minimized immunogenicity as potent PKR inhibitors. Mol Cell 82, 420-434.e426, doi:10.1016/j.molcel.2021.11.019 (2022).
(作者黄宇翔是密歇根大学在读博士研究生,主要研究“细胞自噬的调控机制”,科普作品主要围绕生命科学及相关学科方向)